CHIMIE
Etats de la matiére
Les solides possèdent un volume défini et sont incompréssibles. Mais leur propriété la plus caractéristique est de posséder une forme propre. A l'état solide, les molécules, atomes ou ions constituent des cristaux où ils sont presque immobiles sous l'actions de forces d'interaction plus ou moins intenses. Ce sont ces forces et leur orientation qui donnent la forme propre au solides.
Cristal ionique
Prenons comme exemple le chlorure de sodium. L'atome de sodium a céder un électron (Na+) à l'atome de chlore (Cl-) ce qui crée des éléments chargés. La cohésion d'un cristal ionique est donc assurée par des forces électrostatiques qui existent entre les ions. Cette liaison s'appelle la liaison ionique. Les solides ioniques se dissolvent facilement et ne sont pas en général conducteurs de l'électricité mais le deviennent à l'état dissout.
Exemple : NaCl ou CaF2
Cristal métallique
Le mode de liaison des atomes d'un métal et d'un type particulier mais relève cependant de la mise en commun d'électron. Les atomes perdent leurs électrons situés sur la dernière couche (couche de valence) créant ainsi des ions positifs. C'est ions positifs qui occupent des positions fixes servent d'ossature au métal tandis que les électrons libérés forment un nuage qui se déplace dans le métal. La mise en commun des ions créent une forte cohésion. Tandis que le déplacement des électrons sous forme de nuage crée la malléabilité et permet la conduction des métaux.
Cristal covalent ou atomique
Ici les atomes sont liés à l'aide de liaisons covalente et forment un cristal composé uniquement d'atomes. Ce type de cristaux est assez rare, pratiquement seuls les éléments de la colonne 14 (C, Si) prennent cette forme. La mise en commun d'électrons crée de forte cohésion dans ces cristaux.
Exemple: le graphite, le diamant.
Cristal moléculaire
Dans les cristaux moléculaires, les molécules restent à des distances à peu prés fixe les unes par rapport aux autres. Les forces qui lient les différentes molécules sont assez faibles par rapport aux forces des autres cristaux ce qui donne des cristaux assez "fragile" et ayant des points de fusion peu élevé.
Exemple: Eau (H2O), acide acétique (CH3)
Structure des liquides
Les liquide n'ont pas de forme propre, ils prennent la forme de leur contenant et peuvent circuler dans des canalisations. Les molécules, dans un liquide conservent une certaine mobilité les unes par rapport aux autres, contrairement au solide qui est rigide.Bien que serrées les unes contre les autres, les molécules d'un liquide possèdent une certaine liberté de mouvement, elles sont en constante agitation. Elles ne peuvent pas parcourir de grandes distances mais oscillent et peuvent prendre la place les unes des autres. Cette agitation va croître avec la température. Le phénomène de diffusion constitue une autre preuve que les molécules sont en mouvement. L'exemple d'une goutte d'encre déposé à la surface d'un liquide colorie progressivement tout le volume du liquide. Par contre, les liquides ont un volume propre et sont peu compressibles. Le passage de 1 à 2 atmosphères ne réduit le volume de l'eau que de 0.01%. Ils transmettent donc la préssion et cette propriété est utilisée dans les circuits hydrolyques.
Une même
quantité de matière occupe:
- Un volume moins important à
l'état liquide qu'à l'état solide.
- Un volume moins important à
l'état liquide qu'à l'état gazeux.
La viscosité
La viscosité est
le signe d'une certaine difficulté pour les molécules à se
déplacer, à glisser les unes par rapport aux autres. Cette
viscocité peut avoir deux origines:
- L'existence entre les molécules
d'interactions particulièrement fortes
-La grosseur des molécules: plus
elles sont lourdes et grosses donc de formes compliquée plus
difficilement elles se dégagentles unes par rapport aux autres
(Exemples: les hydrocarbures)
La viscicité se mesure entre
autres à partir de la vitesse d'écoulement.
Les gaz n'ont pas
de volume défini. Ils occupent toujours la totalité du volume
qui leurs sont offert, ils sont expansibles sans limite. Un gaz
peut aussi être comprimé. Pour un gaz on ne parlera pas de
volume du gaz mais de volume occupé par le gaz dans des
conditions déterminées de température de pression et de masse
données. Les gaz peuvent être décrit comme un milieu
constitué de particules (selon le cas atomes ou molécules):
- trés éloignées les unes des
autres
- se déplaçant continuellement
à trés grande vitesse et en ligne droite
- Entrant fréquement en collision
soit entre elles soit avec les parois limitant le volume.
4.Le diagramme d'états des corps purs.
Action de la température sur les corps purs.
Un corps pur est un élément constitué d'une seule espèce chimique simple ou composé. Tous ces éléments peuvent prendre les trois états en fonction de la température et de la pression auxquels ils sont soumis. Quelque soit la température (sauf 0k absolu) d'un corps ses molécules sont soumises à une énergie cinétique (mouvement).
Une élévation de
la température:
-Augmente l'énergie cinétique
des molécules ou atomes
-Eloigne les particules les unes
des autres en agissant contre la force de cohésion du corps
Une décroissance de la température:
-Diminue l'énergie cinétique des molécules ou atomes
-Agit avec la force de cohésion pour ordonner les particules les
unes par rapport aux autres.
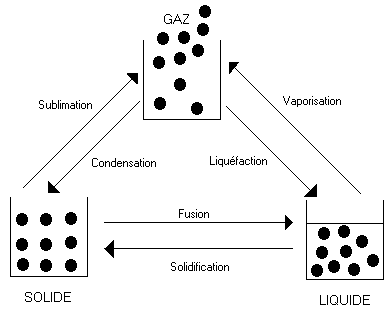
Changements d'états
Chaque passage d'un état à un autre est caractérisé par une chaleur de latence de changement d'état. Chaque changement d'état porte un nom spécifique.

Transformations physiques de la matière
Pour les corps purs la fusion et la solidification se produisent à la même température (température de fusion). La température reste constante pendant la durée du changement d'état. Cette durée ne dépend que du corps.
De même pour l'ébullition et la liquéfaction se produisent à la même température (température d'ébulition). La température reste constante pendant la durée du changement d'état. Cette durée ne dépend que du corps.
Les températures
de fusion et d'ébullition sont constantes pour les corps.
Exemple: le silicium fond à
1410°C et bout à 2680°C (Préssion de 1013 hPa).
Exemple de changement d'états de l'eau
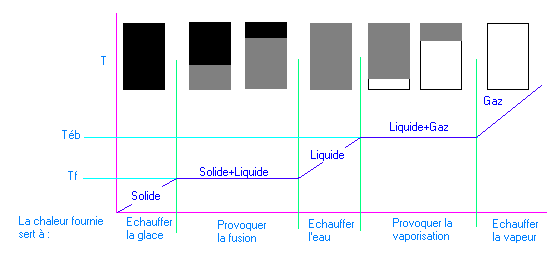
Le diagramme d'état des corps purs
La température n'est pas le seul paramètre qui peut faire passer un corps d'un état à un autre : il y a aussi la pression. Le diagramme d'état permet de visualiser l'influence de ces deux paramètres sur un coprs.
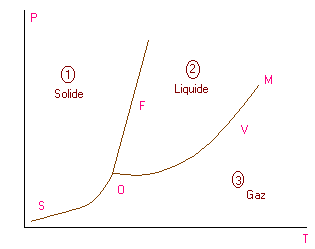
Le plan est divisé en trois régions qui correspond a chacun des états. Le solide ne peut exister hors de la zone 1, de même que le liquide et le gaz ne peuvent exister hors des zones 2 et 3. Les courbes S, V et F sont des lieux géométriques où existe un équilibre entre deux états. Sur ces courbes coexiste deux états, par exemple sur F coexiste l'état solide-liquide qui sont donc en équilibre. Ces trois courbes se rencontrent au point O appelé point triple. En ce point et en ce point seulement le solide, le gaz et le liquide coexiste en équilibre.
5.Changement d'état des corps mélangés à pression constante
Notion de mélange
Un mélange est composé de plusieurs corps purs. Il contient des molécules (ou des ions) de types différents.
Changement d'état des mélanges
Les températures de changement d'état des mélanges ne sont pas des constantes, elles dépendent des proportions des différents corps qui constituent le mélange. Pendant le changement d'état les températures de fusion et d'ébulition varient au cours du temps. Les températures de fusion commençante et de solidification commençante ne sont pas les mêmes non plus.
Etat ultime de la matière. Quand on élève la température à densité constante, on obtient un mélange inséparable d'électrons et de particules chargées électriquement. C'est une substance globalement neutre.