CHIMIE
Exercice
Combien d'atomes de fer contient un cm3 de fer?
Données:
Masse d'un cm3 de fer 7,8 * 10exp-3 kg
Masse d'un atome de fer 9,3 * 10exp-26 kg
Réponse: 8,4 * 10exp+22
Unité légale de quantité de matière : La mole
Pour faire le lien entre les grandeurs à l'echelle des entités élémentaires (ions, molécules,..) et les grandeurs utilisées dans la vie courantes (litres, kilogrammes,..), il a fallut définir un troisième type de grandeur : La mole.
Définition
Pour définir la mole, on a pris comme référence le nombre d'atomes contenu dans 0.0012 kilogramme de carbonne, soit 6,02*10exp23 atomes.
La mole est la
quantité de matière d'un système contenant 6,021*10exp23
entités élémentaires.
Le symbole de la mole est : mol
Lorsque l'on emploie la mole les
entités élémentaires doivent être spécifiées.
La constante d'AVOGADRO
Le nombre d'AVOGADRO (6,02*10exp23 atomes) est égal au nombre d'atomes de carbone 12 contenus dans une mole de carbone 12.
La constante d'AVOGADRO est le nombre d'entités élémentaires contenues dans une mole de ces mêmes entités.
Son symbole est NA, son unité mol exp-1
La masse molaire atomique
La masse molaire atomique d'un élément est la masse d'une mole d'atomes de cet élément. Elle s'exprime généralement en g*mol exp-1. Les masses molaires atomiques des éléments sont données dans la classification périodique
Exemple: Silicium: 28,1g.mol exp-1
La masse molaire des molécules
La masse molaire M d'un corps moléculaire représente la masse d'une mole de molécules. Elle est égale à la somme des masses molaires atomiques des atomes présents dans la molécule.
Exemple: La molécule d'eau : H2O
Masse H2O = 2 Masse H + Masse O = 2*1+16 = 18 g.mol exp-1
Quantité de matière
On appelle quantité de matière nA d'un élément le quotient de sa masse par sa masse molaire.
Avec: nA = m(A) / M (A)
nA= quantité de
matière en mol
m(A)= masse en gr
M(A)= masse molaire en gr/mol
2.La concentration des solutions
Solution, solvant et soluté
Une solution
aqueuse s'obtient en dissolvant un ou plusieurs solutés dans de
l'eau qui constitue le solvant. Nous allons nous intérrésser
aux concentration des différents solutés dans une solution.
Pour cela on definit deux types de
concentrations.
Concentration molaire
La concentration en quantité de matière d'un constituant A est le nombre de moles d'un élément chimique (ion, atomes ou molécules) contenu dans l'unité de volume.
Soit le quotient de la quantité de matière nA (exprimée en moles) du constituant A par le volume V du mélange homogène :
[A] = nA / V mol l exp-1
Concentration massique
La concentration massique d'un constituant A est égale au quotient de la masse mA du constituant A par le volume V du mélange homogène.
t(A) = mA / V g.l exp-1
3.Les ions en solutions aqueuses
Introduction
Lorsque l'on plonge un cristal ionique dans l'eau,il se produit 3 phénomènes :
Décomposition de l'eau
L'eau se décompose ainsi :
2H2O -----> H3O+ + OH-
Les ions OH- sont appelés ions hydroxyde et les ions H3O+ sont appelés ions hydronium |
Définition du pH
Le pH d'une
solution est lié à sa concentration des ions Hydronium en mol exp-1:
[H3O+].
Le pH est défini par la relation
suivante:
A 25°C ........[H3O+] = 10 exp -pH Donc on a aussi la relation, pH = -log [H3O+] |
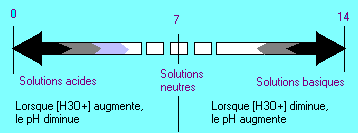
Classification des solutions aqueuse suivant le pH
pH de l'eau pure
Le pH de l'eau pure est è à 25°C...........................A 25°C ...........[H3O+] = 10 exp-7 mol lexp-1
Dans l'eau ultra pure (H2O) la concentration d'ions hydronium est égale à la concentration d'ions hydroxide.
[H3O+] = [OH] = 10 exp-7 mol lexp-1
d'où [H3O+] . [OH] = 10 exp-14 mol lexp-1
Dans toute solution aqueuse on peut écrire : [H3O+].[OH] = 10 exp-14 = Ke
Nous pouvons classer les solutions en deux grandes catégories celles dont le pH est supérieur à 7 et celles donc le pH est inférieur à 7.
Solution acide
Une solution
aqueuse est acide si la concentration des ions hydronium (H3O+)
dans cette solution est supérieure à la concentration de ces
mêmes ions dans l'eau pure.
A la température de 25°C, une
telle solution contient plus de 10 exp-7 moles d'ions
hydronium.
Ex: Jus de citron, acide
fluorhydrique, acide nitrique
Solution basique
Une solution aqueuse est
basique si la concentration des ions hydronium (H3O+) dans
cette solution est inférieur à la concentration de ces mêmes
ions dans l'eau pure.
A la température de 25°C une telle
solution contient moins de 10 exp-7 moles d'ions
hydronium.
Ex: Soude, potasse, eau de javel.
Solutions neutre
Une solution aqueuse est
neutre si la concentration des ions hydronium (H3O+) dans cette
solution est égale à la concentration de ces mêmes ions dans
l'eau pure.
A la température de 25°C, une telle
solution contient 10 exp-7 moles d'ions hydronium
Ex: eau pure, eau salée, eau sucrée.
Remarques:
|
Echelle de pH

Propriétés des solutions acides (en solution aqueuse)
Les solutions acides présentent les caractéristiques suivantes :
Propriétés des solutions basiques (en solution aqueuese)
Les solutions basiques présentent les caractéristiques suivantes: